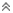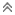خصائص المحاليل الحمضية:
1- الطعم اللاذع.
2- تسبب حروقا لأنسجة الجسم.
1- تتسب في أكل الأقمشة والجلد والورق
2- موصلة للكهرباء
ــــــــ
استخدامات الحموض اربعة وهي:
1- الخل المستخدم في الطعام.
2- يستخدم في حمض الكبريتيك في صناعة الأسمدة والفولاذ والطلاء والبلاستيك.
3- ويستخدم في حمض الهيدروكلوريك.
4- ويستخدم في حمض النيتريك في صناعة الاسمدة والبلاستيك والاصباغ.
تعريف القواعد : هي مواد تستقبل ايونات الهيدروجين بعد ذوبانها في الماء وتنتج ايونات الهيدروكسيد(oh)
ــــــ
خصائص المحاليل القاعدية:
1- زلق كملمس الصابون وطعمها مر.
2- تسبب الحروق والضرر للأنسجة.
3- موصلة للكهرباء
ــــ
استخدامات القواعد:-
1- صناعة الصابون والأمونيا والعديد من مستحضرات التنظيف.
2- منظفات الأفران والطباشير من الأمثلة الشائعة على المنتجات التي تحتوي على قواعد.
3- معالجة حموضة التربة في الحقول والبساتين.
4- هيدرو كسيد الصوديوم.
ــــ
س1/ قارن بين القواعد والحموض؟
ج1/ القواعد تستقبل ايونات الهيدروكسيد و الحموض تطلق ايونات الهيدرونيوم.
الرقم الهيدروجيني ph
الرقم الهيدروجيني ph: هو مقياس لحمضية أو قاعدية المحلول.
وتتدرج قيمتة من صفر الى 14 .
وتتدرج قيمة المحاليل الحمضية من صفر الى 7.فالمحاليل ذات الرقم الهيدرجيني صفر هي الأعلى حموضة.
ومنها حمض الهيدرو كلوريك.
أما الرقم 7 فيعني التعادل.
المحاليل اكثر من 7 هي محاليل قاعدية وتكون الرقم 14 هي الأعلى قاعدية.ومنها محلول هيدروكسيد الصوديوم.
تحوي الحمضية أيونات هيدرونيوم أكثر من أيونات الهيدرو كسيد . أما المحاليل القاعدية فتحوي أيونات الهيدروكسيد اكثر من ايونات الهيدرو نيوم .
ــــــــ
س1/ ما أهية الرقم الهيدروجيني؟
جـ1/ يصنف مقياس الرقم الهيدروجيني PH المواد إلى حمضية أو قاعدية أو متعادلة.
قوة الحمض والقواعد:
ترجع قوة الحمض إلى سهولة انفصاله الى ايونات أو اطلاق ايونات الهيدروجين عند ذوبانه في الماء.
وقوة القاعدة مرتبطة ايضا بسهولة انفصالها الى ايونات او اطلاقها الى ايونات الهيدروكسيد.
قوة الحموض والقواعد
حمضقوي حمض الهيدرو كلوريك ضعيف حمض الأستيك
قاعدة قوي هيدرو كسيد الصوديوم ضعيف هيدروكسيد البوتاسيوم
الكواشف:- هي مركبات تتفاعل مع كل من المحاليل الحمضية والقاعدية .. وتعطي ألوانًا مختلفة حسب قيمة الرقم الهيدروجيني للمحلول.
ــــــ
الحمض : عند وضع ورقة تباع الشمس الزرقاء في محلول حمضي يتحول لونها الى اللون الأحمر.
القاعدة : عند وضع ورقة تباع الشمس الحمراء في محلول قاعدي يصبح لونها ازرق.
ـــــــ
التعادل:- هو تفاعل حمض مع قاعدة وينتج عنة ملح وماء.
ــــ


 العضو الأكثر نشاطاً هذا اليوم
العضو الأكثر نشاطاً هذا اليوم 
 الموضوع النشط هذا اليوم
الموضوع النشط هذا اليوم 
 المشرف المميزلهذا اليوم
المشرف المميزلهذا اليوم 























 العرض المتطور
العرض المتطور